Unapređenje protokola za mikropropagaciju
Phalaenopsis sp. direktnom regeneracijom
izdanaka iz nodusnih reznica
Izvod
U radu je uspešno ispitana mogućnost modifikacije protokola mi-
kropropagacije Phalaenopsis sp. sa ciljem pojednostavljenja samog postupka
uz smanjenje troškova. Rezultati istraživanja su pokazali da se pojedine
komponente podloge (ekstrat tečnog endosperma kokosovog oraha, glutamin
i morfolin-etan sulfonska kiselina) mogu izostaviti, a pojedine, kao što
je pepton mogu zameniti dostupnijim i jeftinijim (sojino brašno) bez gu-
bitka na kvalitetu proizvedenih biljaka. Faktor multiplikacije u radu je
iznosio 7,6 izdanaka po eksplantatu nakon 150 dana gajenja u kulturi in vitro,
a istovremeno na istoj hranljivoj podlozi 60% eksplantata je obrazovalo
korenov sistem koji je uglavnom bio dobro razvijen.
Uvod
Mikropropagacija predstavlja metodu vegetativnog razmnožavanja čijom
primenom se iz malih delova biljaka (embrioni, seme, pupoljci, apikalni
meristem, kalus, pojedinačne ćelije) na veštačkim hranjivim podlogama,
u sterilnim uslovima regenerišu nove biljke. Ona omogućava dobijanje
visokokvalitetnog i zdravog sadnog materijala u kratkom vremenskom periodu,
jer se proizvodnja odvija u kontrolisanim uslovima, ne postoji zavisnost od
godišnjih doba, velika je ušteda na prostoru i vremenu neophodnom za gajenje,
potrebna je mala količina inicijalnog biljnog materijala zbog čega se ne moraju
formirati veliki matičnjaci, a koeficijent multiplikacije je visok. Međutim,
ova metoda ima i svojih nedostataka među kojima su najznačajniji velika početna
ulaganja za opremanje laboratorije i velika cena rada visoko kvalifikovane radne
snage. (D ol e , W i l k i n s , 2004, G r b i ć, 2004, M i š i ć, 2004).
Danas se mikropropagacija koristi u masovnoj proizvodnji mnogih
komercijalno značajnih taksona, a veliki broj njih se masovno razmnožava
isključivo metodom mikropropagacije. Među njima su kultivari cvetno deko-
rativnih biljaka koji pripadaju rodovima Lilium sp., Gerbera sp., Alstroemeria sp.,
Anthurium sp., familiji Orchidaceae, kao i brojni lisnodekorativni taksoni (D ol e ,
Wi l k i n s , 2004).
U komercijalnoj proizvodnji mikropropagacija prvi put počinje da se
koristi prilikom vegetativnog razmnožavanja orhideja, šezdesetih godina pro-
šlog veka (P i e r i k , 1990). U ex vitro uslovima pri vegetativnom razmnožavanju
orhideja, bi bilo potrebno i do deset godina da se dobije nova biljka, a generativno
razmnožavanje bi bilo veoma otežano jer je seme sitno, bez endosperma i da biklijalo neophodno je prisustvo simbiotskih gljiva koje obezbeđuju neophodne hranljive materije (P i e r i k , 1990). Zbog toga je kultura tkiva jedini način
koji se može efikasno koristiti u razmnožavanju orhideja. Do danas, veliki
broj istraživača se bavio iznalaženjem optimalnih uslova mikropropagacije
različitih vrsta orhideja, koristeći hranljive podloge različitog sastava i
različite tipove eksplanata (meristem, listove, segmente stabljika, itd.) kako
bi proces dobijanja ujednačenih i kvalitetnih biljaka bio što jednostavniji
(Ti s s e r a t , Jo n e s , 1999).
Među komercijalno značajnim rodovima orhideja je i Phalenopisis sp. koji je
ujedno i najmanje zahtevan u odnosu na ostale rodove koji se komercijalno gaje, a
njegova proizvodnja, odnosno čitav proces dobijanja biljaka sposobnih za plasman
je kraći (do 15 meseci) i jednostavniji u odnosu na Cymbidium, Dendrobium, Paphiopedilium,
Cattleya (preko 2 godine) (D ol e , Wi l i k i n s , 2004). Interesantno je da
je postupak mikropropagacije za Phalaenopsis razvijen kasnije u odnosu na druge
orhideje, početkom sedamdesetih godina prošlog veka, jer primena uobičajenih
protokola za orhideje je kod kultivara Phalaenopsis rezultirala somaklona-
lnim varijacijama (G r i e s b a c h , 2002). Ipak, istraživanje optimalnih uslova
razmnožavanja Phalaenopsis sp. kulturom tkiva nije izgubilo na aktuelnosti i do
danas su sprovedena brojna istraživanja vezana za mikropropagaciju kultivara
ovog roda, koristeći različite eksplante, među kojima su segmenti internodija
cvetnog stabla, segmenti listova, vrhovi korenova, aksilarni pupoljci na cvetnom
stablu (Ts e et al., 1971, R e i s i n g e r et al., 1976, To k u h a r a , M i i , 1993, A r r d i t t i ,
E r n s t , 1993, Ic h i h a s h i , 1997, I s h i i et al., 1998, Pa r k et al., 2002). Ko š i r et al. (2004)
preporučuju direktnu regeneraciju izdanaka iz nodusa cvetnih stabala kao metod
kojim se mogućnost pojave somaklonalnih varijacija svodi na minimum, pri tom
sprovodeći detaljna istraživanja koja su imala za cilj iznalaženje jednostavnog
protokola za pomenuti metod razmnožavanja. Međutim, postavlja se pitanje koliko
je primena rezultata koje su dobili K o š i r et al. (2004) komplikovana i skupa,
odnosno da li se njihov protokol može dodatno modifikovati tako da postane
dostupan i slabije opremljenim laboratorijama, bez velikih ulaganja. Na ovaj
način bi komercijalno razmnožavanje Phalaenopsis sp. bilo jednostavnije i ne bi
bilo dostupno samo usko specijalizovanim i skupim laboratorijama, već bi bilo
prihvatljivije za male proizvođače, kolekcionare i hobiste jer danas „kućno”
razmnožavanje pojedinih biljaka kulturom tkiva postaje sve popularnije (Home
tissue culture Group, 2012).
Mogućnost ekonomične proizvodnje ukrasnih biljaka kod nas putem
mikropropagacije, bez narušavanja kvaliteta i produktivnosti su ispitivali
G r b i ć i R a d a n ov (1992). Cilj njihovih istraživanja je bio, između ostalog i da
se pronađe ekonomičan način za osnivanje manjih laboratorija za kulturu tkiva
u okviru rasadnika i time omogući primena mikropropagacije u uslovima naše
rasadničke proizvodnje. Primenom rezultata njihovih istraživanja troškovi
osnivanja laboratorije su svedeni na neverovatnih 2% od sredstava potrebnih za
nabavku klasične opreme u doba objavljivanja rada.
Pored opreme, veliki značaj u mikropropagaciji ima složenost celog
postupka što dovodi do potrebe za za visoko kvalifikovanom radnom snagom.
Većina vrsta koje se razmnožavaju mikropropagacijom se mogu gajiti na standarnim
sterilnim podlogama sa dodatkom agara i makro i mikroelemenata, najčešće MS
rastvora mineralnih soli (Mu r a s h ig e , S ko o g , 1962), uz dodatak odgovarajućeg
balansa fitohormona (V i n t e r h a l t e r, V i n t e r h a l t e r, 1997). Međutim, sastav
hranljive podloge kod orhideja je nešto složeniji i obično uključuje i dodavanje
tečnog endosperma kokosovog oraha, peptona, kao i glutamina (Si n h a et al., 2007).
V i n t e r h a l t e r i V i n t e r h a l t e r (1997) navode da se neke komponente (kao što je
mioinozitol) dodaju u hranljive podloge često po automatizmu, jer su se pokazale
uspešnim kod drugih vrsta, što ne mora da znači da su neophodne i kod ispitivane
vrste. Vodeći se time, cilj naših istraživanja je bio da se ustanovi da li se
sastav hranljive podloge za razmnožavanje orhideja može pojednostaviti i da li
se njegovom modifikacijom mogu smanjiti troškovi. U tom smislu, ispitana je
mogućnost mikropropagacije odabranog kultivara Phalaenopsis ”Pink Butterfly” na
podlogama na kojima su izostavljeni tečni endosperm kokosovog oraha i glutamin,
a umesto peptona je na osnovu istraživanja vezanih za podloge za klijanje spora
gljiva upotrebljeno sojino brašno (R a d u l i ć, 1996). Takođe, saharoza koja je
dodavana u hranljive podloge nije bila pro analysi čistoće, već je korišćena deset
puta jeftinija saharoza namenjena ljudskoj ishrani koja je uglavnom zadovoljavajuće
čistoće za mikropropagaciju mnogih vrsta (T h o r p e et. al., 2008), ali ne postoje
podaci o njenom korišćenju prilikom razmnožavanja orhideja.
2. Materijal i metod rada
Za istraživanje je odabrana zdrava matična biljka Phalaenopsis ”Pink Butterfly”
koja je nabavljena u maloprodajnom objektu u Beogradu. Odabrana biljka je
imala obrazovana tri cvetna stabla sa kojih su uzeti pupoljci koji su korišćeni
kao inicijalni materijal za uspostavljanje kulture in vitro u novembru 2011.
godine. Sav materijal je bio poreklom od jedne matične biljke.
Sa cvetnih stabala su isecane nodusne reznice dužine oko 3 cm. Svaki
nodus je imao dormantan lateralni pupoljak sa kog je pažljivo uklonjena brakteja,
a zatim je izvršena površinska sterilizacija u 4% rastvoru NaOCl sa dodatkom
2-3 kapi preparata Tween 20. Sterilizacija je trajala 10 minuta, a zatim su reznice
isprane u laminarnoj komori 3 puta po dva minuta sterilnom destilovanom vodom
i postavljene na medijum. Prilikom postavljanja na medijum, krajevi reznica
dužine 5-7 mm su odsečeni.
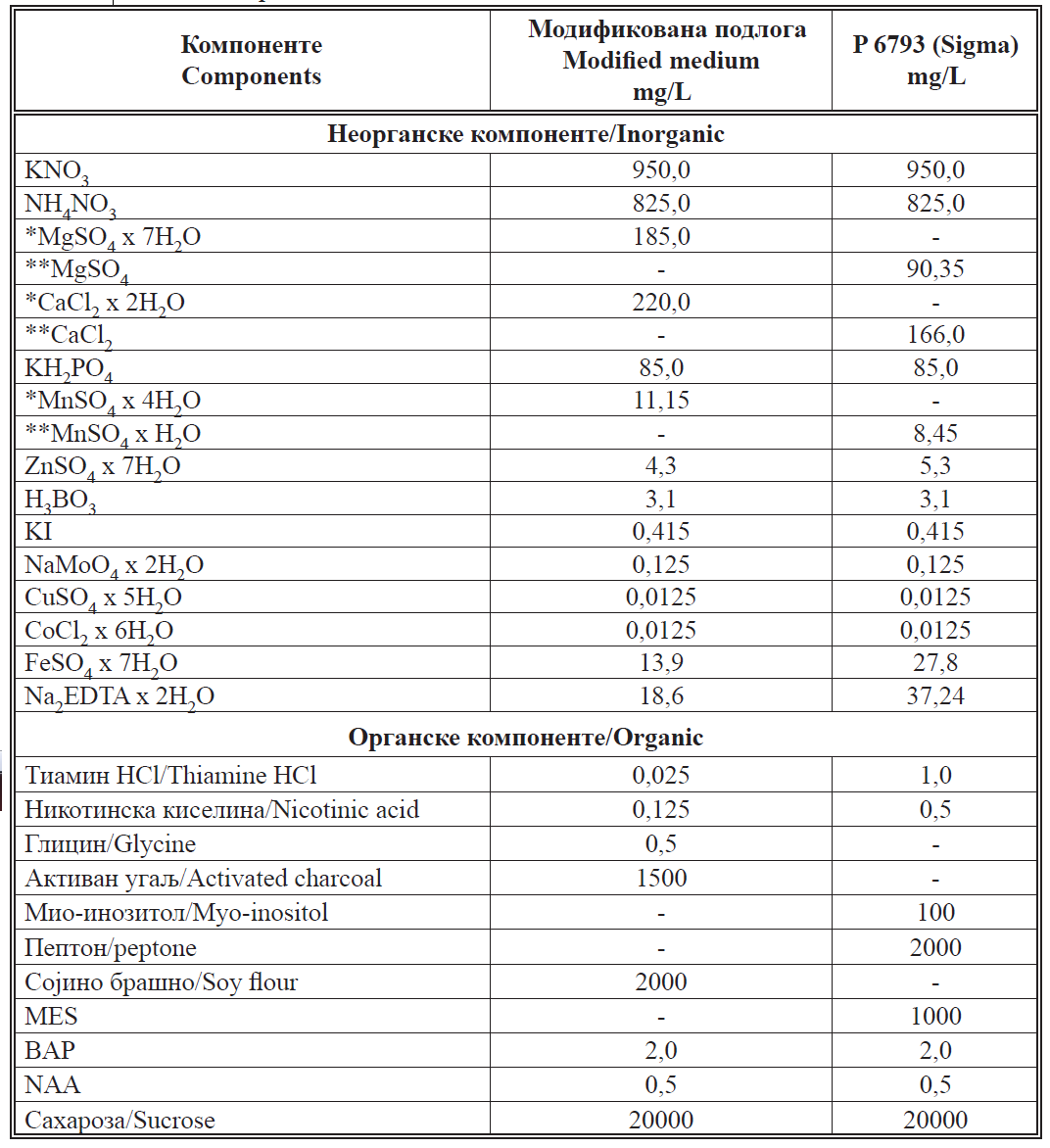
Hranljiva podloga za multiplikaciju izdanaka je imala modifikovan
i pojednostavljen sastav. K o š i r et al. (2004) su testirali efekat nekoliko
medijuma koje različiti autori preporučuju za mikropropagaciju falenopsisa.
Najpovoljnije rezultate su dobili korišćenjem komercijalne podloge P 6793 koju
proizvodi Sigma (2011) (tabela 1). Vodeći se rezultatima njihovih istraživanja, kao i preporukama Si n h a et al. (2010) koristili smo podlogu koja je sadržala MS (Mu r a s h ig e , S ko o g , 1962) mineralne i organske komponente u upola
manjoj koncentraciji, kao i 2% saharozu, 8% agar, 2 g/L sojinog brašna (umesto
peptona) i 1,5 g/L aktivnog uglja, 2 mg/L BAP (benzil-aminopurin) i 0,5 mg/L
NAA (naftil-sirćetna kiselina) (tabela 1). Pre autoklaviranja na pritisku od
1,5 atm i temperaturi od 120º C u trajanju od 20 minuta, podešena je pH vrednost
medijuma na 5,3 dodavanjem 0,1 N HCl i 0,1 N NaOH. Nakon toga je podloga razlivena
u staklene posude, zapremine 120 mL, prečnika 3,5 cm, sa 30-35 mL po posudi koje
su zatvorene zatvaračima od gaze, vate i aluminijumske folije.
Kulture su gajene u sobnim uslovima, bez regulacije fotoperioda, pri
temperaturi koja se kretala između 20°C i 28°C. Trajanje subkulture je bilo 30 dana.
Nakon svake subkulture određen je broj izdanaka, kao i pojava ožiljavanja,
a dobijeni podaci su statistički analizirani u odgovarajućem statističkom
programu, pri čemu su određeni: standarna devijacija uzorka, standarna greška
aritmetičke sredine i koeficijent varijacije.
- Tabela 1. * Hidratne soli upola koncentracije prema Murashige, Skoog, (1962)/ * Soli sa manjim sadržajem kristalne vode prema specifikaciji proizvoda (Sigma, 2011), pri tom su koncentracije soli identične u obe podloge kada se obračunaju molekuli vode/ *MES – Morfolin-etan sulfonska kiselina/ * BAP – Benzilaminopurin/ * NAA – Naftilsirćetna kiselina.
3. Rezultati sa diskusijom
Inicijalna faza je uspešno obavljena, svega 14,3% postavljenih reznica je
bilo kontaminirano (2 reznice od 14 postavljenih). Kontaminacija se ispoljila
posle 5-7 dana nakon postavljanja reznica, a kontaminirane reznice su ponovo
sterilisane i postavljene na svež medijum.
Nakon 20 dana po postavljanju kod svih reznica, uključujući i kontaminirane
(ponovo sterilisane) došlo je do proliferacije dormantnih pupoljaka, što se i
očekivalo u skladu sa rezultatima koje su dobili Košir et al. (2004). Pupoljci su
razvili kratke izdanke dužine oko 1 cm, koji su 30 dana od postavljanja odvojeni
od stabljike i postavljeni na svež medijum.
U drugoj subkulturi izdanci su razvili listove, 2-5 listova po
postavljenom eksplantatu, a kod pojedinih eksplantata u pazuhu listova je došlo
do proliferacije pupoljaka. Formirani busenovi su prebačeni na svež medijum,
a od treće subkulture, broj novih pupoljaka dužine preko 5 mm, koji se mogu
odvojiti od matičnog busena i postaviti na svež medijum je evidentiran. Podaci
dobijeni u trećoj, četvrtoj i petoj subkulturi prikazani su u tabeli 2. Zbog malog
broja eksplantata kao i zbog razlika u veličini i stepenu razvijenosti busenova,
navedene tri subkulture nisu mogle da se posmatraju kao ponavljanja eksperimenta,
pa je prilikom statističke obrade podataka određena samo standarna devijacija
uzorka, kao i standarna greška aritmetičke sredine i koeficijent varijacije.
Kao što se u tabeli 2 može videti broj novih izdanaka koji su se razvili iz
aksilarnih pupoljaka nakon 30 dana gajenja u kulturi in vitro dostigao je najviše
3, dok kod određenog broja izdanaka nije došlo do proliferacije pupoljaka.
Uglavnom su u pitanju mladi izdanci koji su odvojeni od matične biljke i tokom
subkulture su samo razvili listove.
Kao što se u tabeli 2 može videti broj novih izdanaka koji su se razvili iz
aksilarnih pupoljaka nakon 30 dana gajenja u kulturi in vitro dostigao je najviše
3, dok kod određenog broja izdanaka nije došlo do proliferacije pupoljaka.
Uglavnom su u pitanju mladi izdanci koji su odvojeni od matične biljke i tokom
subkulture su samo razvili listove.
Prosečan broj izdanaka je bio najmanji u trećoj subkulturi (1,3), a neznatno
viši u ostale dve, 1,5 i 1,4 respektivno. Dobijeni rezultat je sasvim zadovoljavajući
ako se uzme u obzir da su za 160 dana (5 subkultura) gajenja u kulturi in vitro K o š i r
et al. (2004) najpovoljniji rezultat dobili na P 6793 podlozi, od 14 eksplantata
ukupno 117 novih izdanaka (117/14 = 8,35 po eksplantatu). Za 5 subkultura (150
dana), sa faktorom multiplikacije 1,5 dobili bismo 7,6 novih izdanaka, što je
kada se uzme u obzir stepen modifikacije medijuma, kao i variranje temperature
i fotoperioda tokom rasta kultura, sasvim zadovoljavajuća vrednost, neznatno
niža od 8,35. Šta više, može se očekivati da su na ovaj način dobijene biljke već
tokom same mikropropagacije postepeno prilagođene na temperaturne oscilacije
i razlike u osvetljenosti čime će i njihova aklimatizacija biti lakša. U odnosu
na rezultate koje su K o š i r et al. (2004) dobili sa ostalim tipovima hranljivih
podloga, p rema p reporukama A r d i t t i i E r n s t (1993), T i s s e r a t i Jo n e s (1999),
rezultati prikazani u našem radu su daleko povoljniji.
Interesantno je da su izdanci tokom naših istraživanja, uprkos visokoj
koncentraciji BAP-a (2 mg/L) formirali korenove (slika 1). Korenovi su fo-
rmirani nakon 60 dana gajenja (2 subkulture), 1 – 4 korenova po eksplantatu, kod
60% postavljenih eksplantata. Dužina korenova se kretala od 1 – 5 cm. K o š i r et
al. (2004) su korenove kod malog broja biljaka dobili na podlozi P 6793, kao i na
podlozi koja je sadržala samo BAP (2 mg/L) bez auksina, a najveći broj eksplantata
u njihovom radu je regenerisao korenove na podlozi bez fitohormona. U poslednja
dva slučaja sastav podloge je bio isti (sa izuzetkom BAP-a), a razlikovao se od
podloge P 6793 prema sadržaju makro soli, pri čemu se značajna razlika ogledau znatnom smanjenju sadržaja gvožđa, FeSO4 x 7 H2O je potpuno izostavljen, a
koncentracija helata Na2EDTA x 2H2O smanjena, što je prisutno i u našem radu
gde je koncentracija FeSO4 x 7H2O i Na2EDTA x 2H2O upola niža u odnosu na P
6793 (tabela 1). Time se potvrđuje pretpostavka koju su izneli Košir et al., (2004)
da smanjenje sadržaja gvožđa u podlozi podstiče formiranje korenova prilikom
mikropropagacije falenopsisa.
- Tabela 2. Broj izdanaka dobijenih nakon 30 dana gajenja u kulturi ïn vitro“
4. Zaključak
Osnovni cilj naših istraživanja je postignut, uz smanjenje troškova
i pojednostavljenje sastava hranljive podloge dobijene su vitalne biljke, uz
relativno visok faktor multiplikacije.
Sojino brašno se može koristiti umesto peptona, a kokosovo mleko
(ekstrat tečnog endosperma), glutamin i morfolin-etan sulfonska kiselina se
mogu izostaviti u hranljivim podlogama za mikropropagaciju falenopsisa.
Takođe, umesto saharoze laboratorijske čistoće uspešno se može koristiti
saharoza namenjena ljudskoj ishrani čime se cena ove komponente smanjuje deset
puta.
Na formiranje korenova značajno utiče smanjenje koncentracije gvožđa
u hranljivoj podlozi, mada se preporučuje da se sprovedu dodatna istraživanja
koja bi uključila ispitivanje uticaja različitih koncentracija auksina na
ožiljavanje izdanaka.
Svakako da se na prikazani način ne može postići veliki obim i kvalitet
proizvodnje kakav se postiže u velikim komercijalnim laboratorijama u svetu, alije prikazani metod više nego koristan za male obime proizvodnje, gde su zahtevi
tržišta ograničeni, gde je hiperprodukcija ekonomski neopravdana i gde se za
relativno kratko vreme može dobiti potreban broj biljaka. Ne treba zaboraviti
ni manje značajnu prednost prikazane metode, koja zbog svoje jednostavnosti
doprinosi popularizaciji kulture tkiva, jer na prikazani način Phalaenopsis
mogu razmnožavati kolekcionari i uopšte ljudi kojima je cvećarstvo hobi.
autori:
Marija Marković
Miloš Tanasić
Nevena Stojić
Radivoje Bulatović
Marta Jović
Slobodan Vidojković
Dušan Stanković
UDK: 635.9:582.594:581.165.7
Originalni naučni rad
DOI: 10.2298/GSF1206141M
http://glasnik.sfb.bg.ac.rs/prikazi_clanak.php?id=1262


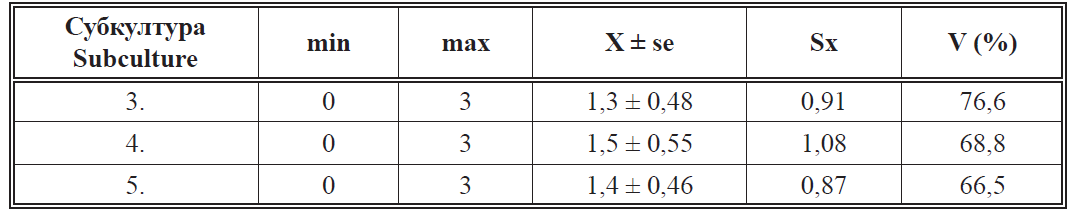





Baš bih volela ovo da probam. Ovo je istraživački rad,obični smrtnik još nije probao(kod nas u Srbiji,ili nisam čula za to?)potrebno je hemije ,instrumenti…mislim što se tiče pravljena same podloge za in vitro razmnožavanje orhideje,ostalo mogu sama😉. Eto ,ako postoji neko ko ima uslove za pravljenja podloge neka se javi🤔,da se dogovorimo i podelimo poslove😂. Možda ispadne neki bizniz od toga😏.